
刘合力
课题组PI简介
刘合力,北京大学医学部药学院研究员,博士生导师,国家自然基金优秀青年基金获得者(2013),国家海外高层次人才计划“青年项目”获得者(2012),北京大学优秀青年人才“百人计划”入选者(2011);美国西北大学Feinberg医学院分子药理学与生物化学系,博士后、Research associate (2006~2011);中国科学院生物物理研究所,生物化学与分子生物学博士(2005);Elsevier 期刊Current Research in Pharmacology and Drug Discovery和《中国药学》英文版的编委会成员。长期致力于细胞表面受体的信号转导结构机制和靶向药物研究。以第一作者或者通讯作者身份在Cell、Nature Communications、PNAS、EMBO. J、J Autoimmun.、JBC、FEBS letters等期刊发表了多篇研究论文;受邀在Current Opinion in Structural Biology上发表综述1篇;申请蛋白质类候选药物的国家发明专利2项(其中一项已经获得授权;另一项为选择性识别致癌突变KIT ITD的靶向单克隆抗体);获得了国家海外高层次人才计划、国家自然基金优秀青年基金、3个国家自然基金面上项目和1个北京市自然基金面上项目等资助。
课题组网页:http://222.28.103.88/labhome/(限于北医校园网用户)
研究介绍
细胞表面受体是全球60%药物的作用靶标,且蕴藏着癌症、神经精神类疾病等诸多重大疾病的药物靶标而亟待发现和确证。探讨潜在药物靶标的结构与功能关系,是精准调控它们功能的基础,是药物靶标确证不可或缺的重要步骤。本课题组将结构生物学技术与传统的药理学研究方法相结合,力图形成有自己特色的研究方向,即“细胞表面受体的分子和结构药理学研究”,旨在探讨细胞表面受体跨膜信号转导的结构机制、基于结构机制发现调节受体功能的分子工具(小分子化合物、单抗、蛋白质)、为癌症或自闭症等神经精神类疾病确证新的药物靶标,以此助力于原创性(first-in-class)“精准药物”的发现。
我们先后着力于受体酪氨酸激酶(receptor tyrosine kinases, RTKs;如KIT、CSF1R、PDGFRa、ROR2)、受体酪氨酸磷酸酶(receptor-type protein tyrosine phosphatases, RPTPs;如PTPd)、神经粘连受体(CASPR2、ADAM22、neurexin、neurofascin)、粘连型G蛋白偶联受体(LPHN3、BAI3、FSHR)、整合素以及具有GAP(GTPase激活蛋白)活性的受体Plexin等的信号转导结构机制和靶标确证。近期的主要研究内容,简介如下:
1、孤独症相关的信号复合体SALM/LAR-RPTP的信号转导机制和靶标确证
孤独症相关的突触样黏附分子-5(synaptic adhesion-like molecule 5,SALM5)位于神经突触后膜,可以结合位于突触前膜的白血球共同相关抗原受体酪氨酸磷酸酶(leukocyte common antigen-related receptor-type protein tyrosine phosphatases, LAR-RPTPs,LAR-RPTPs)家族成员从而诱导突触前膜分化,但两者互作的结构机制尚不清楚。我们用单对同晶置换兼反常散射法、分子置换法解析了SALM5 LRR-Ig结构域以及其与LAR-RPTPs 家族成员PTPδ的Ig1-3结构域(且小外显子MeA缺失)的复合物的晶体结构;通过结构指导的定点突变实验、“糖锲子(glycan wedge)”引入策略、pulldown、化学交联、表面等离子体共振、蛋白-细胞免疫荧光、超速离心分析、海马神经元突触形成等实验,证明了SALM5的二聚化是其发挥介导突触前膜分化功能的前提,发现SALM5通过与受体酪氨酸磷酸酶LAR-RPTP反式互作形成独特的2:2的信号复合体结构而引起突触分化(图1),并指出SALM5的结合将调控LAR-RPTP的磷酸酶活性(至于如何调控有待进一步研究)以及基于此结构机制筛选靶向药物的可能性(Nature Commun.2018 Jan 18; 9(1):268;Current Opinion in Structural Biology. 2019 Feb 8; 54:59-67)。
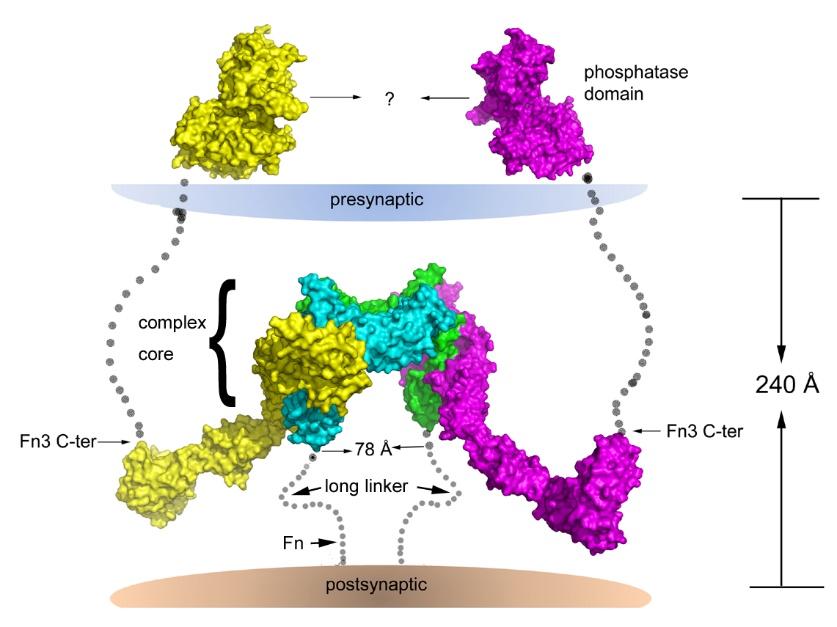
图1、突触后膜上的SALM5(绿色/天青色)诱导并激活突触前膜上的受体PTPδ(黄色/洋红色)二聚化的结构机制【Nature Commun.2018 Jan 18; 9(1):268】。
2、孤独症相关的神经粘连受体CASPR2识别自免疫抗体的结构基础
作为neurexin超家族的成员之一,CASPR2曾被认为是控制神经发育的分子网络的中心。编码CASPR2的基因CNTNAP2敲除的小鼠表现出孤独症样行为;CASPR2的自免疫抗体可能是一类孤独症或自身免疫类边缘性脑炎的致病源。我们解析了CASRP2的DISC结构域近原子分辨率(1.31埃)的晶体结构,基于结构设计并重组表达了一系列突变体,与法国里昂第一大学合作,用抗CASPR2边缘性脑炎病人的脑脊液,通过ELISA实验,确定了该结构域的一个loop-tip表面是CASRP2识别自免疫抗体的关键区域(J Autoimmun. 2019 Jan; 96:168-177)
3、肿瘤微环境的重要构成蛋白periostin同亲性粘连的结构机制
作为细胞表面受体整合素(integrin)的潜在配体,periostin在肿瘤微环境中通过与其他蛋白互作或与自身同亲性粘连而扮演多重角色:可重塑肿瘤微环境,可提高肿瘤细胞的低氧生存能力和耐药性,是潜在的抗肿瘤药物靶点。但其结构与功能关系一直未知。我们获得了人源periostin以及C60S突变体的晶体结构,结合多角度光散射、同亲性粘连实验和质谱实验,首次从结构上确定了periostin的同亲性粘连受EMI结构域调控;并利用质谱结合晶体结构首次发现Cys60发生了半胱氨酸化修饰。相关成果发表在FEBS Lett. 2018 Jun; 592(11):1789-1803,并被该期刊选为2018年度亮点文章(FEBS Letters Highlights 2018)。
4、受体酪氨酸激酶CSF1R的配体IL-34的蛋白质二硫键工程
白介素IL-34是CSF1R的一个配体,可以选择性增强小胶质细胞的神经保护功能,从而减轻b-amyloid的神经毒性,有望被开发成治疗AD的蛋白质药物。对于蛋白类药物,保质期以及在体内的半衰期是决定成药性的重要条件,而这些条件与蛋白的热稳定性有关系。我们曾解析了白介素IL-34的晶体结构,揭示了IL-34/CSF1R识别的结构机制,并发现IL-34的内部分别位于两个a-螺旋的残基Ser98和Cys168的侧链之间形成弱氢键(Biochim Biophys Acta. 2012 1824(7):938-45)。鉴于此,我们将人源IL-34的Ser98突变成Cys,用同步辐射圆二色谱实验证实突变体比野生型IL的变性温度提高了7.6°C;用晶体结构证实突变体与野生型IL-34的总体结构高度相似,且激活CSF-1R自磷酸化及诱导细胞增殖的能力无明显差异。本发明已经获得国家发明专利授权(ZL2016102555350.1)。
5、非典型性受体酪氨酸激酶ROR2的靶标确证
ROR2属于非典型性受体酪氨酸激酶(RTK),多数学者认为其并不像经典的RTK那样具有酪氨酸激酶活性。ROR2在正常组织中低表达甚至不表达,而在黑色素瘤等肿瘤中高表达;且Wnt5A-ROR2信号轴对肿瘤进展十分重要。为此,ROR2是潜在的抗肿瘤药物靶点,但亟待确证。基于Wnt5A-ROR2信号转导的结构机制,发现破坏Wnt5A-ROR2相互作用且抑制ROR2信号的分子工具(蛋白质或单抗),是我们实现ROR2靶标确证的基本策略。
一方面,我们利用室内X光源上硫原子的单波长反常信号测定了Wnt5A拮抗蛋白家族sFRPs(secreted Frizzled-related proteins)成员sizzled的晶体结构,并利用双荧光实验证实该家族蛋白的CRD结构域是捕获Wnt蛋白的分子工具(图2)(J Biol Chem.2017 Sep 29; 292(39):16055-16069)。

图2、Sizzled的结构和功能关系。(1)非洲爪蟾Sizzled的晶体;(2)利用单波长反常散射法找到三个硫原子,并以此计算相位合成的电子密度图可见Sizzled含有两个相对独立的结构域;(3)结构分析表明其NTR结构域具有新的折叠模式;(4)A、比较Sizzled全长结构(CRD结构域,天青色;NTR结构域,浅棕色;PAM,棕榈酰基团,红色)与mFrizzled-XWnt8复合物结构(mFrizzled的CRD结构域,绿色;XWnt8,粉色);B、两结构在XWnt8 index finger区域的差异细节;C、两结构在XWnt8 thumb区域的差异细节;(5)Sizzled以及突变体Sizzled CRD C115S、Sizzled CRD C115S/H116Y/H118F的分子筛色谱图以及SDS-PAGE结果;(6)在Wnt3a引发HEK293细胞的双荧光实验中,相较于野生型Sizzled,其突变体可显著地拮抗Wnt3a信号。
另一方面,我们利用siRNA或慢病毒递送shRNA进行“功能失去性”(loss-of-function)实验,证实ROR2对肿瘤细胞增殖、侵润和迁移的作用;利用杂交瘤技术获得了22株抗ROR2的单克隆抗体,并发现8H6等单抗能抑制Wnt5A-ROR2信号介导的肿瘤转移;利用生物化学或结构生物学技术,我们发现这些抗体作用于ROR2的特定结构域而发挥功能。
6、基于结构机制的受体酪氨酸激酶KIT突变体的靶标确证
受体酪氨酸激酶(RTK)是药物可及性(druggability)最高的细胞表面受体家族,其致癌性突变备受关注,但多数研究是以小分子抑制剂为干预手段针对RTK 的胞内激酶结构域。第三类RTK 胞外区的致癌性突变主要集中在第5 个Ig 样结构域,而KIT 的A502、Y503 的内部重复串联(internal tandem duplication,ITD)突变(下称KIT ITD)为其中最有代表性的致癌性突变。KIT ITD突变体在10%的胃肠道间质瘤中高表达,与病人预后差和KIT靶向药物伊买替尼的耐药性密切相关;但该突变体是否可以成为药物靶标尚不清楚。
我们曾较为深入地研究过第三类RTK受体的信号转导机制【KIT/SCF(Liu& Chen et al., EMBO J. 2007 26(3):891-901), PDGFb/PDGFRb(An & Liu et al., PNAS 2010 107(25):11307-12), CSF1/FMS (Chen et al., PNAS, 2008 105(47):18267-72) 以及IL34/FMS (Liu et al., Biochim Biophys Acta. 2012 1824(7):938-45)】,并基于信号转导的结构机制,设计合适的抗原免疫小鼠以及合适的突变体用于ELISA筛选,利用传统的杂交瘤技术获得了包括3G2在内的7株可以选择性识别KIT ITD的单克隆抗体。
对于3G2单抗,我们利用表面等离子体技术测定出其与KIT ITD的亲和力高于与KIT WT(野生型)的(近10倍);采用流式细胞术实验证实了3G2 抗体可差异性地识别稳定表达KIT WT 及KIT ITD的Ba/F3 细胞;发现3G2 抗体能有效抑制离体的稳定表达KIT ITD 的Ba/F3 的细胞,其IC50 为1.29 nM;通过BALB/c 鼠荷瘤实验,我们发现3G2 抗体可以抑制稳定表达KIT ITD的Ba/F3 肿瘤的生长;利用同步辐射光源测定了3G2 Fab/KIT ITD 复合物的晶体结构,阐明了3G2抗体选择性识别KIT ITD的结构基础(图3)。其次,我们初步探讨了3G2 抗体的作用机制,并发现3G2 抗体可以抑制KIT下游信号分子ERK、AKT 及S6分子的磷酸化水平,可促使KIT ITD分子的内化,并导致KIT ITD的Ba/F3细胞的程序性凋亡。
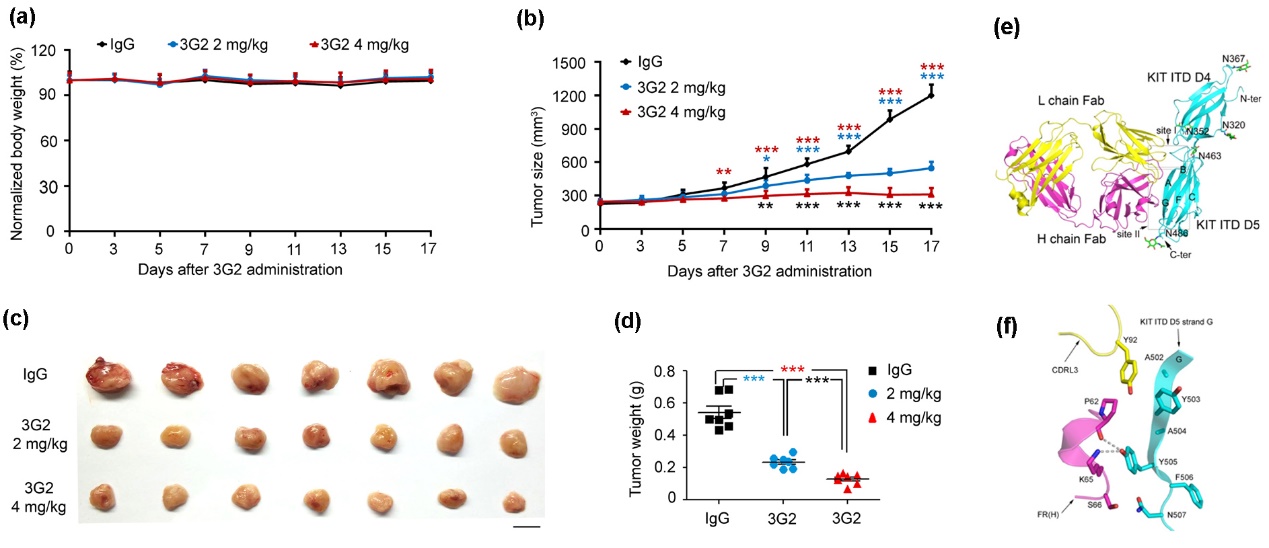
图3、3G2抗体抑制小鼠体内Ba/F3 KIT ITD肿瘤生长及与抗原的复合物结构。(a-b) Ba/F3-KIT ITD502-503异种移植小鼠在分别给予2 mg/kg、4 mg/kg的3G2抗体及4 mg/kg的IgG(对照组)后测量的体重(a)和肿瘤尺寸(b);初始体重设为100%。(c-d) 在第17天处死小鼠后所取肿瘤的照片(c)和瘤体重量(d)。比例尺:1cm。对于(a)、(b)及(e)所展示数据为平均值±均值标准误差(以误差线表示)。用Microsoft Excel软件的双尾Student’s t test计算p值;***p < 0.001,**p < 0.01,*p < 0.05。(e)KIT D4-D5 ITD与3G2 Fab复合物结构的飘带模式图;(f)KIT ITD突变区与3G2互作的界面,参与相互作用的氨基酸以棍棒模式展示,氢键以虚线展示;颜色代码:KIT D4-D5 ITD,天青色;3G2重链,紫色;3G2轻链,黄色。
代表性成果
1. Liu H*. Synaptic organizers: synaptic adhesion-like molecules (SALMs). Current Opinion in Structural Biology. 2019 Feb 8; 54:59-67. (Invited review) (hereinafter *corresponding author)
2. Liang W#, Zhang J#, Saint-Martin M#, Xu F, Noraz N, Liu J, Honnorat J*, Liu H*. Structural mapping of hot spots within human CASPR2 discoidin domain for autoantibody recognition.J Autoimmun. 2019 Jan; 96:168-177 (#equal contribution)
3. Liu J, Zhang J, Xu F, Lin Z, Li Z, Liu H*. Structural characterizations of human periostin dimerization and cysteinylation. FEBS Lett. 2018 Jun; 592(11):1789-1803 (FEBS Letters Highlights 2018)
4. Lin Z, Liu J, Ding H, Xu F, Liu H*. Structural basis of SALM5-induced PTPδ dimerization for synaptic differentiation. Nature Commun. 2018 Jan 18; 9(1):268
5. Bu Q, Li Z, Zhang J, Xu F, Liu J, Liu H*. The crystal structure of full-length Sizzled from Xenopus laevis yields insights into Wnt-antagonistic function of secreted Frizzled-related proteins. J Biol Chem. 2017 Sep 29; 292(39):16055-16069
6. Jiang X*, Fischer D, Chen X, McKenna SD, Liu H, Sriraman V, Yu HN, Goutopoulos A, Arkinstall S, He X. Evidence for follicle-stimulating hormone receptor as a functional trimer. J Biol Chem. 2014 May 16;289(20):14273-82
7. Jiang X*, Liu H, Chen X, Chen PH, Fischer D, Sriraman V, Yu HN, Arkinstall S, He X. Structure of follicle-stimulating hormone in complex with the entire ectodomain of its receptor. Proc Natl Acad Sci U S A. 2012 Jul 31; 109(31):12491-6
8. Liu H, Leo C, Chen X, Wong BR, Williams LT, Lin H, He X*. The mechanism of shared but distinct CSF-1R signaling by the non-homologous cytokines IL-34 and CSF-1. Biochim Biophys Acta. 2012 Jul; 1824(7):938-45
9. Liu H, Focia PJ, He X*. Homophilic adhesion mechanism of neurofascin, a member of the L1 family of neural cell adhesion molecules, Journal of Biological Chemistry, 2011.1.7, 286(1): 797-805
10. Liu H, Juo ZS, Shim AH, Focia PJ, Chen X, Garcia KC, He X*. Structural basis of Semaphorin-Plexin recognition and viral mimicry from Sema7A and A39R complexes with PlexinC1. Cell. 2010 Sep 3; 142(5):749-61 (Commented by F1000)
11. Shim AH#, Liu H#, Chen X, Lin PC, He X*. Structures of a platelet-derived growth factor/propeptide complex and a platelet-derived growth factor/receptor complex. Proc Natl Acad Sci U S A. 2010 Jun 22; 107(25): 11307-12 (#equal contribution)
12. Liu H, Shim AH, He X*. Structural characterization of the ectodomain of a disintegrin and metalloproteinase-22 (ADAM22), a neural adhesion receptor instead of metalloproteinase: INSIGHTS ON ADAM FUNCTION, Journal of Biological Chemistry, 2009.10.16, 284(42): 29077-29086 (selected as Papers of the Week)
13. Chen X, Liu H, Focia PJ, Shim AH, He X. Structure of macrophage colony stimulating factor bound to FMS: diverse signaling assemblies of class III receptor tyrosine kinases.Proc Natl Acad Sci U S A. 2008 Nov 25;105(47):18267-72
14. Chen X,Liu H, Shim AH, Focia PJ, He X.Chen X, et al. Structural basis for synaptic adhesion mediated by neuroligin-neurexin interactions. Nature Struct Mol Biol. 2008 Jan;15(1):50-6.
15. Liu H#, Chen X#, Focia PJ, He X*. Structural basis for stem cell factor-KIT signaling and activation of class III receptor tyrosine kinases, The EMBO Journal, 2007.2.7, 26(3): 891-901 (#equal contribution)
16. 刘合力、黄国龙等,一种提高白介素IL-34热力学稳定性的方法,中国发明专利授权号ZL2016102555350.1
17. 刘合力、丁焕弟等, 一种选择性识别KIT ITD致癌性突变的单克隆抗体及其应用,中国发明专利申请号201810588853.X
招聘招生
1、博士后:欢迎神经/肿瘤生物学或药理学、低温电镜结构生物学的博士(毕业0-5年)来合作开展高水平研究,待遇从优。2、招生:欢迎有志于在结构水平研究生物医学规律或追求原创性药物发现的研究生、本科生来学习。